Wasserstoff aus Methan
 |
|
||||||||||||
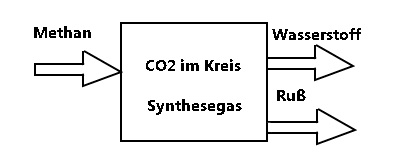
Der Trick dabei ist, man verwendet CO2 im Kreislauf, es entsteht zunächst H2 und CO. Über das Boudouard-Gleichgewicht erhält man wieder CO2 und das zweite Produkt Ruß.
Zur Tabelle:
Es sind also für die erste Reaktion 247 KJ/mol aufzubringen. Eine gleichzeitige Entfernung des Wasserstoffes wurde Druckanwendung begünstigen.
Bei der zweiten Reaktion werden dann 394-222=172 KJ/mol frei. Dazu wäre meine Idee: CO vorsichtig auf Druck und Temperatur bringen. Der Joule-Thomson-Effekt sollte dann nach einer Düse den Ruß ausfällen.
Wasser hat die Bildungsenthalpie von -242 KJ/mol. Ohne Energierückführung würde man die Hälfte des Wasserstoffes für die Energieerzeugung benötigen.
Eine andere Möglichkeit:
Wasserdampf reagiert mit Methan zu Kohlenmonoxid und Wasserstoff und benötigt dabei 206 KJ/mol. Mit der Wassergas-Shift-Reaktion sind es 248 KJ/mol und erhält weiteren Wasserstoff und Kohlendioxid.
Nachteil: Es wäre dann kein "grüner" Wasserstoff mehr.
Vorteil: Man erhält CO2 rein, ohne störende Gase.